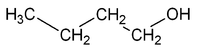Isomería en Química Orgánica
Hay dos tipos básicos de isomería: plana y espacial.
1
[editar]Isomería constitucional o estructural
Debido a esto se pueden presentar 3 diferentes modos de isomería:
•
Isomería de cadena o esqueleto.- Los isómeros de este tipo tienen componentes de la cadena acomodados en diferentes lugares, es decir las
cadenas carbonadas son diferentes, presentan distinto esqueleto o estructura.
Un ejemplo es el
pentano, del cual, existen muchos isómeros, pero los más conocidos son el isopentano y el neopentano

• Isomería de posición.- Es la de aquellos compuestos en los que sus grupos funcionales o sus grupos sustituyentes están unidos en diferentes posiciones.
• Isomería de grupo funcional.- Aquí, la diferente conectividad de los átomos, puede generar diferentes grupos funcionales en la cadena. Un ejemplo es el ciclohexano y el 1-hexeno, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico o cicloalcano y el 1-hexeno es un alqueno. Hay varios ejemplos de isomeria como la de ionización, coordinación, enlace, geometría y óptica.
[editar]Isomería de cadena u ordenación
Varía la disposición de los átomos de C en la cadena o esqueleto carbonado, es decir la estructura de éste, que puede ser lineal o tener distintas ramificaciones.
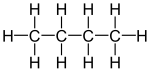 |  |
|---|
Butano
n-butano | Metilpropano
iso-butano ó terc-butano |
Para la fórmula
C5H12, tenemos tres posibles isómeros de cadena:
pentano,
metilbutano (isopentano) y
dimetilpropano (neopentano). El número de isómeros de cadena crece rápidamente al aumentar el número de átomos de carbono.
[editar]Isomería de posición
La presentan aquellos compuestos que poseen el mismo
esqueleto carbonado pero en los que el grupo funcional o el sustituyente ocupa diferente posición.
Por ejemplo, la fómula molecular
C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH: el
1-butanol y el
2-butanol.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|
| 1-butanol, Butan-1-ol o n-butanol | 2-butanol, Butan-2-ol o sec-butanol |
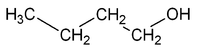 |  |
Este tipo de isomería resulta de la posibilidad de colocar
grupos funcionales,
cadenas laterales o átomos sustituyentes en posiciones estructuralmente no equivalentes. Supongamos que sustituimos uno de los
átomos de
hidrógeno del
butano, CH
3-CH
2-CH
2-CH
3, por un
grupo hidroxilo. Numerando los carbonos de la cadena del butano y realizando esta sustitución en el carbono extremo (C1), obtenemos un alcohol llamado butan-1-ol (
1-butanol). Si sustituimos un hidrógeno del C2 por el grupo -OH, obtenemos el alcohol isómero butan-2-ol (
2-butanol), que difiere en la posición del grupo hidroxilo. Obsérvese que, sin embargo, si realizamos la sustitución en el C3, no obtenemos un tercer isómero, sino de nuevo el 2-butanol. Las dos representaciones que se indican para el 2-butanol son estructuralmente idénticas, como se puede ver girando su estructura 180º alrededor de un eje.
[editar]Isomería de compensación o por compensación
A veces se llama
isomería de compensación o
metamería la de aquellos compuestos en los cuales una función corta la cadena carbonada en porciones de longitudes diferentes.
2
| HCOO-CH2-CH2-CH3 | CH3-COO-CH2-CH3 |
|---|
| Metanoato de propilo | Etanoato de etilo |
Este tipo de isomería era más usado en el pasado que en la actualidad. Se aplicaba incluso a
aldehídos-
cetonas,
3 a los que hoy se suelen considerar isómeros de función.
[editar]Isomería de función
Varía el grupo funcional, conservando el esqueleto carbonado.
Es un tipo especial de isomería en la que existe transposición de un átomo entre las dos estructuras, generalmente hidrógeno, existiendo además un fácil equilibrio entre ambas formas
tautómeras.
4
Un ejemplo de la misma es la
tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.
 |
|---|
| Tautomería ceto-enólica. |
[editar]Isomería espacial o estereoisomería
Presentan estereoisomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta, o sea, difieren en la orientación espacial de sus átomos.
Los isómeros tienen igual forma en el plano. Es necesario representarlos en el espacio para visualizar las diferencias. Puede ser de dos tipos:
isomería conformacional e
isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples, o no.
Otra clasificación los divide en
enantiómeros (son imágenes especulares) y
diastereoisómeros (no son imágenes especulares). Entre los diastereoisómeros se encuentran los isómeros cis-trans (antes conocido como isómeros geométricos), los confórmeros o isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros.
[editar]Isomería conformacional
En este tipo de isómeros conformacionales
5 o
confórmeros, la conversión de una forma en otra es posible pues la
rotación en torno al eje del enlace formado por los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre de
rotámeros. Si los grupos son voluminosos podría haber impedimento estérico y no ser tan fácil la interconversión entre rotámeros.
Los isómeros conformacionales generalmente no son separables o aislables, debido a la facilidad de interconversión aun a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que sí son aislables (la mayoría son derivados del bifenilo) se llama
atropisomería.
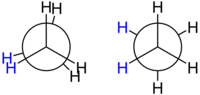
Estas formas se reconocen bien si utilizamos la
proyección de Newman, como se aprecia en los dibujos de la izquierda. Reciben nombres como sinclinal (a veces, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.
5
|
|
|
|---|
| Proyecciones de Newmann para la molécula de etano. Formas eclipsada y alternada. | Distintas conformaciones del etano según la rotación en torno al eje que forman los dos átomos de carbono.
Se observan formas eclipsadas o formas escalonadas. |
[editar]Isomería configuracional
No basta una simple rotación para convertir una forma en otra y aunque la disposición espacial es la misma, los isómeros no son interconvertibles. Se divide en: isomería geométrica o cis-trans, e isomería óptica. Los isómeros configuracionales son aislables, ya que es necesaria una gran cantidad de energía para interconvertirlos (se requiere energía necesaria para la ruptura de enlaces),
Isomería geométrica o cis-trans
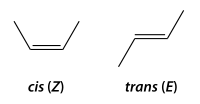
Formas
cis y
trans en compuestos con doble enlace C=C, o con doble enlace N=N
Se produce cuando hay dos carbonos unidos con doble enlace que tienen las otras valencias con los mismos sustituyentes (2 pares) o con dos iguales y uno distinto.
No se presenta isomería geométrica ligada a los enlaces triples o sencillos.
A las dos posibilidades se las denomina:
- forma cis (o forma Z), con los dos sustituyentes más voluminosos del mismo lado, y
- forma trans (o forma E), con los dos sustituyentes más voluminosos en posiciones opuestas.
No se pueden interconvertir entre sí estas dos formas de un modo espontáneo, pues el doble enlace impide la rotación, aunque sí pueden convertirse a veces, en reacciones catalizadas.
La isomería geométrica también se presenta en compuestos con doble enlace N=N, o en compuestos cíclicos en los que también se impide la rotación en torno a un eje.
1,2-dimetilciclopentano
(formas cis y trans) | cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis y trans
del difluorodiazeno |
|---|
 |  |  |  |
Isomería óptica o Enantiomería
Los isómeros ópticos no se pueden superponer y uno es como la imagen especular del otro, como ocurre con las manos derecha e izquierda. Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de la
luz polarizada en diferente dirección:
- un isómero desvía la luz polarizada hacia la derecha (en orientación con las manecillas del reloj) y se representa con el signo (+): es el isómero dextrógiro o forma dextro;
- el otro isómero óptico la desvía hacia la izquierda (en orientación contraria con las manecillas del reloj) y se representa con el signo (-)(isómero levógiro o forma levo).6
Otra forma de nombrar estos compuestos es mediante el convenio o
nomenclatura D-L, normalmente empleando la
proyección de Fischer. Esta nomenclatura es absoluta pero no necesariamente la forma (D) coincide con el isómero dextrógiro o forma (+).
7

Formas R y S del bromoclorofluorometano.
También pueden representarse estos isómeros con las letras (R) y (S). Esta
nomenclatura R-S, que sigue las
reglas de Cahn-Ingold-Prelog, también se utiliza para determinar la configuración absoluta de los carbonos quirales.
Así pues, hay tres sistemas de nombrar estos compuestos:
- según la dirección de desviación del plano de la luz polarizada, distinguimos las formas dextro (+) y levo (-);
- según la nomenclatura D-L (Formas D y L), que es inequívoca para isómeros con un solo carbono asimétrico,8 y
- según la configuración absoluta R-S (formas R y S),9 más adecuada para moléculas con varios centros asimétricos.
Diasteroisómeros
Cuando un compuesto tiene más de un carbono asimétrico podemos encontrar formas enatiómeras (que son imagen especular una de la otra) y otras formas que no son exactamente copias espaculares, por no tener todos sus carbonos invertidos. A estas formas se les llama
diasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol posee dos carbonos asimétricos por lo que tiene 4 formas posibles. De ellas, algunas son enantiomorfas (formas especulares), como (2S,3S)-3-bromo-butan-2-ol y (2R,3R)-3-bromo-butan-2-ol. En cambio, (2R,3S)-3-bromo-butan-2-ol es un diastereoisómero de los dos anteriores.
Mezcla racémica y formas meso

Formas R y S del ácido láctico. Enantiómeros del
ácido láctico o ácido 2-hidroxipropanoico.
Una
mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva..
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de
forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una
concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de altura. Es el mismo para ambos
enantiómeros, aunque de signo contrario. Se mide con el
polarímetro.
10
[editar]Isomería en Química Inorgánica
Hay varios tipos de isomeria presente en compuestos inorgánicos, sobre todo en complejos de coordinación,
11 pero este fenómeno no es tan importante como en
química orgánica:
- Isomería estructural o topológica: Los átomos se unen de modo diferente, como en el S2F2, de los que existe una molécula en forma de cadena y otra en forma de pirámide triangular. Un caso especial es la tautomería, en la que un átomo de H cambia de posición.
- Isomería conformacional: Igual a la ya comentada para compuestos orgánicos. Se presenta en compuestos con enlace sencillo como P2H4 o el ion ditionito, S2O42-, donde existen formas eclipsadas, escalonadas y sinclinal (gauche).
- Isomería cis-trans (geométrica): Aparece en compuestos como el ácido nitroso, HNO2, o en complejos de coordinación plano-cuadrados como [PtCl2(NH3)2].
- Isomería de posición, como en algunos heterociclos de azufre y nitrógeno. En el S6(NH)2 se mantiene el anillo octogonal del azufre pero dos átomos de azufre han sido sustituidos por grupos NH,que pueden estar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: también aparece en compuestos de coordinación de estructura tetraédrica con sustituyentes diferentes.
- Isomería de ionización: Se intercambian un ligando del catión con uno de los aniones que lo neutralizan,como ocurre entre [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complejos, podemos intercambiar sus ligandos y obtendremos isómeros diferentes, como ocurre entre [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].

Isomería de enlace en un complejo de Cobalto
- Isomería de enlace: Algunos ligandos pueden unirse de modo diferente al ion central,como ocurre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+12
- Isomería de polimerización: Es el caso de NO2 y N2O4, dos óxidos de nitrógeno gaseosos.





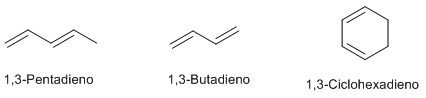
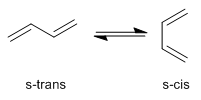
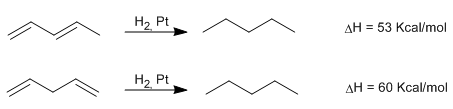
 Dobles enlaces conjugados.
Dobles enlaces conjugados.


 →
→